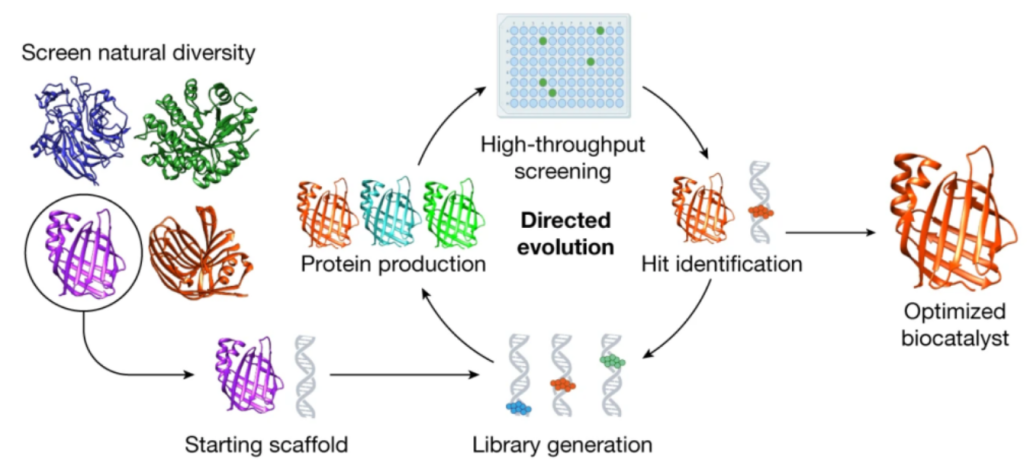
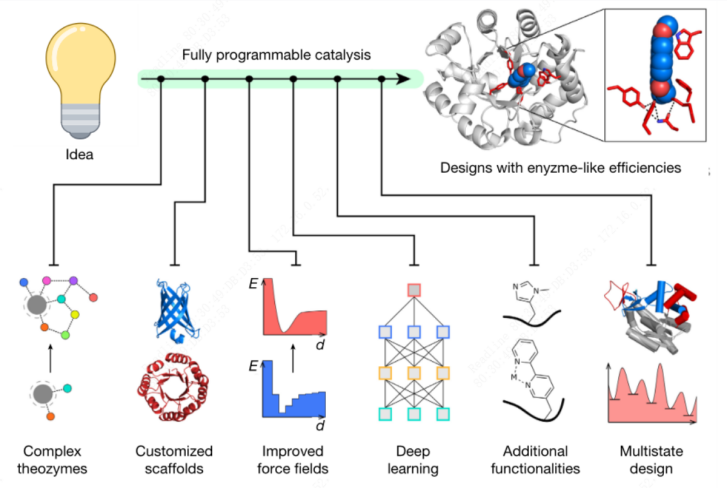
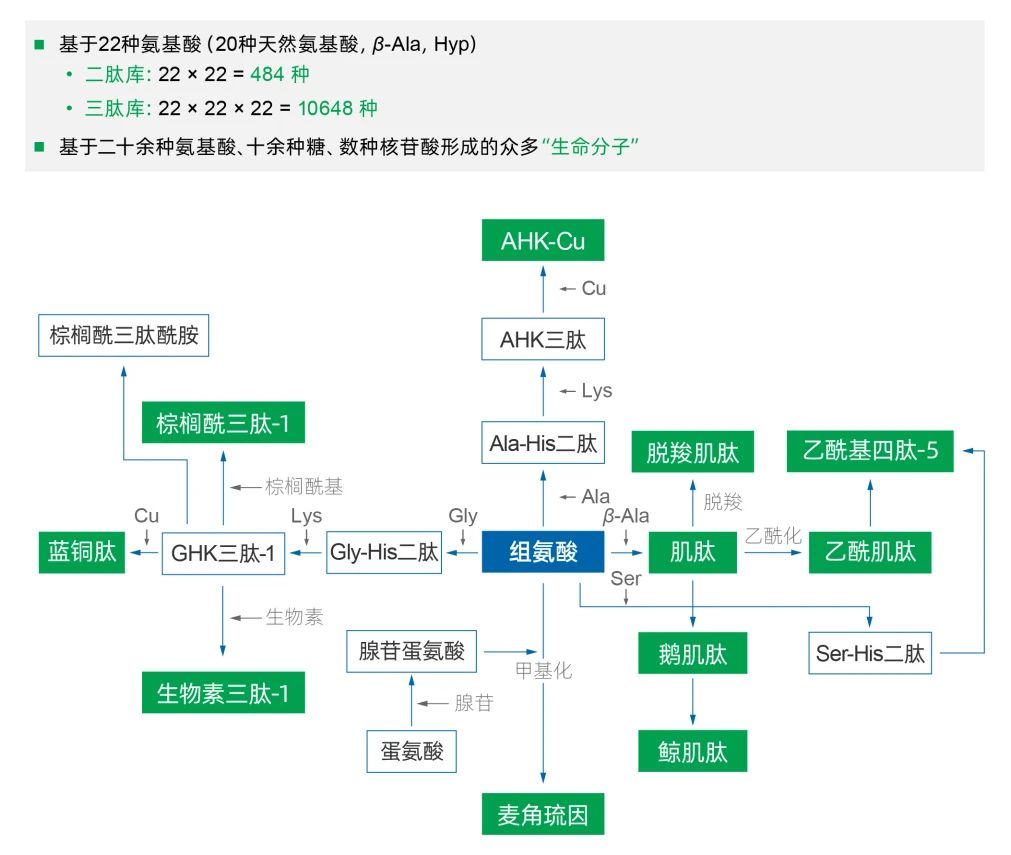
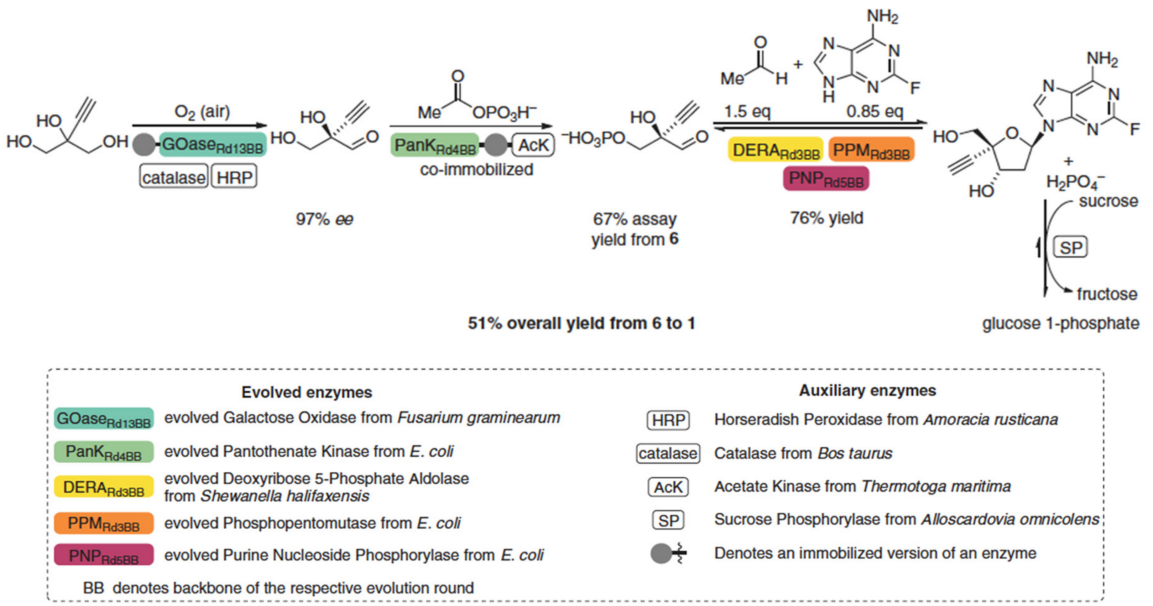
应用科学,让合成生物学从基础科学向产业实践转化
发表于:2023-10-23
来源:
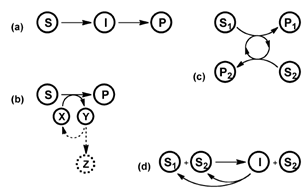
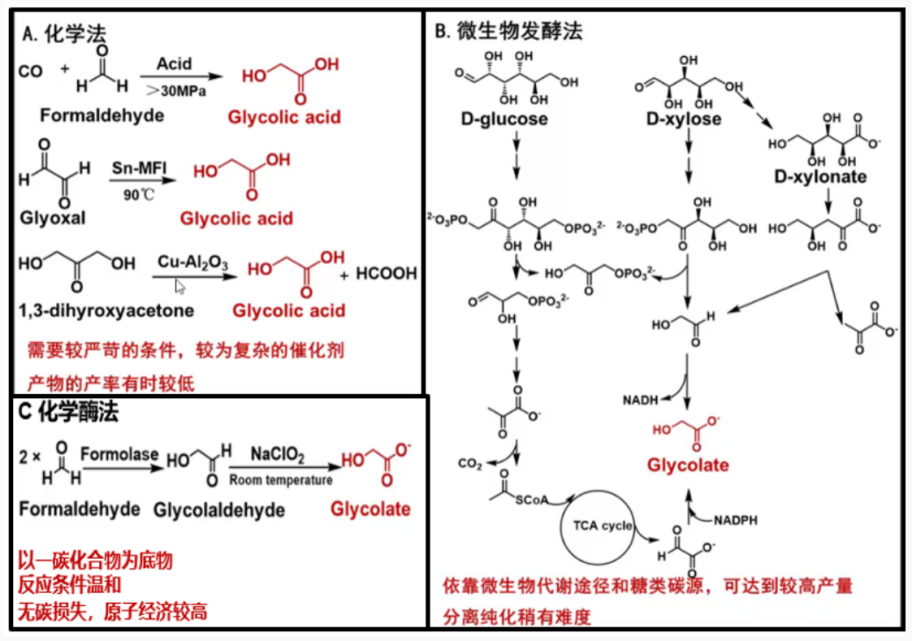
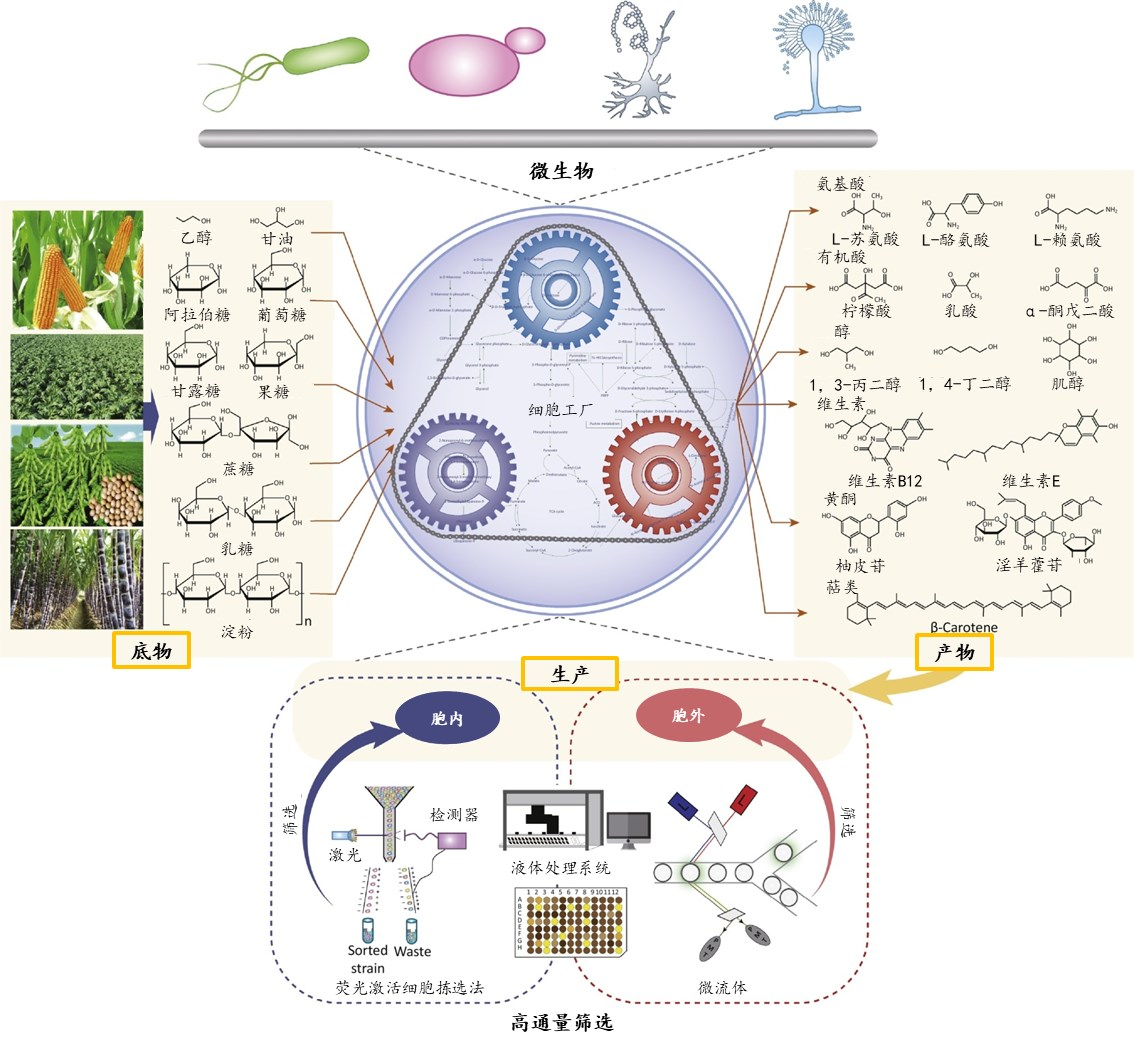
我国绿色生物制造与合成生物学发展已进入新一轮技术和产业升级节点,挑战与机遇并存。为共同研讨合成生物学技术创新、应用平台和产业化、商业化机遇,首届生物智造·绿色科技行业论坛暨“想象 · 现实 · 未来——让合成生物梦想照进现实”研讨会将在2023-11-03隆重举行。本次论坛及研讨会主办单位为深圳瑞德林生物技术有限公司和深圳市松禾资本管理有限公司,合作单位为深圳市高新技术产业促进中心,指导单位为合成生物产业创新联盟,承办单位为肽研社。诚邀各领域人士进行多维度交流合作,共同探讨合成生物学底层技术、产业化、商业化的难点与未来发展方向。合成生物学采用工程科学研究理念,对生物体进行有目标地设计、改造乃至重新合成,创建赋予非自然功能的“人造生命”。基因测序、编辑及合成技术、计算生物学、人工智能等一系列底层赋能技术的突破加速合成生物学发展,从此开创了以构建分子机器 (体外催化) 和细胞工厂 (体内催化) 为代表的合成生物制造的新兴生物工程领域,拉开了合成生物学在各个领域产业化应用的序幕。从终产物合成位置的角度来看,生物合成路径分为胞内生产和胞外生产。胞内生产即搭建细胞工厂,通过对底盘细胞的改造、胞内酶和代谢通路的改造和调控等,使微生物直接代谢终产物。细胞工厂目前广泛应用于大宗化学品和天然产物的生产。胞外(体外)生产关键点在于无细胞酶促体系的构建,对催化酶进行理性/半理性设计实现进化,在体外构建酶级联反应以简化工艺流程,某些流程还可结合化学合成提高收率。虽然细胞工厂利用整合的概念一劳永逸地将代谢物转化所涉及到的所有酶一并构建在细胞内,但是体外酶催化具有独特优势。合理应用底层赋能技术搭建应用平台,同时从产业化与商业化视角出发正确选择终产物的生产方式,对于合成生物企业来说至关重要。因此,一个合格的合成生物平台企业要想从基础科学向产业实践转化,细胞工厂构建、酶的定向进化和筛选、无细胞酶促合成体系和与化学合成的结合是必修课。酶具有在催化反应时不会改变自身的结构或被消耗、可重复使用、反应条件简单易控、高效催化等特点,因此成为了合成生物学研究当中的关键元件,通过对于不同酶元件的组装,研究人员在许多目标分子反应路线的设计上取得了突破。物种在自然界中进化伴随着酶的进化,而酶的定向进化是一个建立在分子基础上的人为过程,它将天然进化过程转移到实验室并进行加速。酶的定向进化的实质是一个迭代过程,包括确定起始酶(定向进化起点)、基因多样化、酶蛋白质表达和功能筛选、再多样化、再筛选等,直到在酶活性、结合亲和力或特异性方面达到令人满意的性能水平,即达到定向进化终点。尽管定向进化功能强大,其高成本、高耗时以及对部分反应缺乏起始模板等问题的存在,限制了其在工业应用上的广泛推广,因此理性设计和半理性设计等设计策略应运而生,用以优化酶的性能,或是改变酶的反应底物、反应路线等。催化酶的改造研究已有超40年的历史:1978年Hall首先开始了实验室酶的定向进化以探索新功能酶;2001年David 开始蛋白的从头设计建模;2010年Anderson 通过电脑对酶进行重新设计来解决细菌耐药性问题;2018年Arnold 因对酶定向进化的杰出贡献获得诺贝尔化学奖。整体看来,酶的改造历史由原先的人工选择定向进化,逐步进入半理性设计与理性设计阶段。与人工选择的酶定向进化不同,酶的半理性设计策略,具体是基于分子层面上对酶的氨基酸序列精准引入突变,使酶活性位点及附近或酶表面发生的突变有助于优化催化活性,从而产生更有效的酶库。这是一种基于酶氨基酸序列-酶空间结构-酶功能三者之间关系的理解结合随机引入突变的方法。具体步骤在编辑酶的部分片段基因中引入突变,形成酶的基因突变库 ;利用蛋白质表达载体对酶进行表达,形成酶蛋白质突变库;对酶的功能进行选择或者筛选;判断本轮进化是否达到目的以及决定是否进行新一轮定向进化。酶半理性设计对自动化、高通量设备要求极高,要求高通量挑蛋白、挑菌落、精准滴液及培养自动化,均需要软硬件的配合。酶的半理性设计策略在工业应用广泛,在Merck与Codexis开发的Islatravir酶合成工艺中充分体现了这种酶半理性设计应用的普适性。该设计包含以下几个基本步骤:1) 通过酶资源库信息分析比对、筛选具有该活性的酶;2) 利用酶与底物结合信息创建小的突变体库进行筛选;3) 对整个基因进行随机突变筛选(可循环多轮)。当前,以定点突变为起点的半理性设计目前已发展成为两个分支:一是根据蛋白质一维的氨基酸序列,进行随机突变、定向筛选,获得性能提高的突变体。二是根据蛋白质三维结构和催化机制,以理性的方式选取拟改造活性位点并构建突变体来提高酶的性能。而随着计算和人工智能技术的发展,理性设计正使半理性设计的两个分支正在呈现合二为一的趋势,开发从DNA序列到蛋白质功能的新酶设计策略和人工智能新算法,在先进算法指导下进行计算机虚拟筛选及从头设计,显著提高了蛋白质改造的效率。与半理性设计不同的是,酶的理性设计需要知道详细的结构和基因信息,直接定点设计所需要的催化剂。由于结合了计算化学、计算生物学、有机化学、酶学、结构生物学、蛋白质理性设计、定向进化等多领域的专业知识,理性设计降低了传统诱变与人工筛选所带来的工作量,一定程度地摆脱了高成本、长周期消耗,同时借助高通量筛选,精准实现了催化酶的定向改造。当前国内部分企业已具有催化酶的理性设计能力,例如,合成生物学领跑企业瑞德林正在建立全国第一个二肽酶库,覆盖22种氨基酸的400余种组合,可快速完成新酶挖掘、功能改造、表达系统建立及催化工艺优化,以应用到生物合成中改变原有功效护肤、营养健康等原料化学合成的方式,推动降本增效,改变原料格局。我国研究团队也在催化酶的挖掘取得巨大进步,涌现出了一批出色的研究团队。来自华南师范大学的黄华研究员长期专注于微生物酶资源的鉴定与改造,实现微生物代谢、微生物发酵以及微生物酶工业催化的理论与应用研究。现承担国家自然科学基金“酶组学”面上项目“酶组学法揭示糖酸在人体微生物中的转化网络”。酶催化聚焦于酶的设计与改造,以体外无细胞形式执行生物合成,是合成生物学在体外反应的一种表现形式。相较于胞内合成,生物体外催化能通过对多个酶在实际生产条件下的性能进行工程化改造,多个酶同时参与级联反应来简化工艺流程,减少中间产物或副产物的产生,避免了副产物对细胞的毒害,提高收率与纯度,同时节省了生产成本,尤其在合成一些结构简单且常用化合物时体外酶促体系优势更为明显。相较于复杂化学路线,体外酶级联反应也往往颇具竞争力。传统生产工艺中使用的化学合成存在操作过程繁琐、设备要求较高、工业排放量污染环境、产品纯度低、副产物较多等痛点。相比之下,酶催化技术的优势更加明显,不仅避免了使用有毒催化剂,还能最大限度降低能耗,不需要投入过大的成本,在降低溶剂使用量的基础上,保证最终产品纯度更高。对于复杂结构的人工合成药物,最早的原研路线通常为多步化学法,近年来,出于绿色环保、节约能源的角度,如何将原有的化学法转化为体外酶催化级联法也已成为一大新兴研究领域。在Merck与Codexis利用9种酶成功构建了HIV治疗药物Islatravir的体外多步酶法催化级联体系,该路线总收率达到51%,所需步骤远少于之前报道的化学路线(12-18步)。酶法不但无需化学反应中常用的保护基团,同时还能提供对立体选择性的精确控制,这可能是该酶级联反应能够缩短步骤并提高产率的主要原因。无细胞酶促合成体系的构建核心在于酶催化级联反应体系的构建,有多种类型,目前最通用的分为以下四类:a)线性级联反应; b)正交级联反应; c)平行级联反应; d)循环级联反应。经典的例子是重要手性药物中间体——手性胺,采用的是线性级联反应,同样能够完成辅酶(如NADH)的循环。实际的级联反应中,通常不会只应用一种反应类型,而是多类结合应用,氧化还原酶、转氨酶等则是其中最常应用的酶类。国内有许多关于酶促合成并成功推向产业化的案例。来自华东理工大学的郑高伟教授团队紧密围绕“药物手性砌块的高效酶促合成”开展应用基础研究,重点解决酶应用中天然酶与非天然底物不适配及酶与工业应用环境不兼容关键技术瓶颈。团队通过3年时间开发了一条(R)-硫辛酸不对称合成的绿色酶催化技术,使得产品合成步骤缩短一半,产品收率提高一倍以上,生产成本降低27%,三废排放减少45%。体外酶促合成体系虽然发展势头迅猛,但仍然存在一些挑战:一是辅酶循环的问题,体外循环需要用到ATP、NADPH等价格昂贵的辅酶,除了成本问题外,在构建循环体系时需同时考虑辅酶循环体系。二是酶的稳定性问题,部分酶在体外的稳定性较差,大规模稳定生产存在困难。三是多酶协作的问题,体外多酶的协作往往不如在体内有序高效。四是酶的重复利用问题,当大规模反应后,酶用量将成为不可忽视的成本。五是处理分离的问题,有些反应中,产物与酶一样,高度溶解于水相,不易用结晶、盐析等便捷的方法与酶有效分离,将面临后续分离的巨大成本问题。化学合成长期以来一直用于制备复杂化合物,尤其是那些难以从天然来源获得的化合物,可以通过新反应、新试剂、新路线,合成毫克级至吨级的产品,现有的实验设备、工业设备、产业链十分成熟、完善。尽管化学合成存在污染等问题,至今仍是不可替代的生产方式。生物合成的出现解决了合成化学发展以来面临的几个问题:1)能源问题:化学合成原料来源属于非再生资源,如石油等;2)工艺问题:反应步骤多,反应条件严苛,提取困难等;3)环境污染问题:合成化学有机溶剂大量使用引起环境污染,1948年获得诺贝尔医学奖获得者Paul Hermann Müller是DDT分子的发现者和推广者,而后DDT分子被证实引起了严重环境污染。生物合成的应用也不是一蹴而就,存在其应用劣势,现阶段还无法完全替代合成化学。其中,生物合成相较于合成化学最主要的劣势是生物系统本身的可控性及天然酶对非天然产品的适用性较差,其次生物催化工艺的开发往往周期漫长,投入巨大,严重限制了合成生物技术的推广。因此,未来的生产方式应是酶催化和生物发酵融合于化学合成方法中,化学合成和生物合成两大生产方式不存在零和博弈,而是共生成长。目前已有大量通过化学-酶法制备医药中间体、天然产物的案例。一碳化合物可被微生物利用并转化为多种平台化合物,生物制造路线虽有助于甲烷气体减排,可拓宽生物制造原料来源。但亟需突破一碳化合物生物利用效率低、转化途径匮乏等难题,通过使用化学-酶法,建立高效的化学和生物级联催化路线可克服这些问题,实现一碳气体的高效耦合和集成利用。化学-酶法开发领域也涌现出了一批优秀的研究团队。中科院天津工业生物技术研究所研究员袁波,师从英国曼彻斯特大学Nicholas. J. Turner教授,长期专注于生物催化、酶工程、酶固定化以及功能性分子合成的研究。具体研究方向包括:生物催化的手性氧化还原反应,利用半乳糖氧化酶等酶催化的手性拆分、去消旋化反应进行复杂分子的合成;轴手性化合物的生物催化转化反应,利用酶催化或级联反应进行轴手性化合物的合成;纳米杂合酶固定化体系创制与应用,利用新型功能性纳米材料进行杂合体系创制与反应扩大化及其应用研究。化学-酶法实现了化学合成与生物合成有机结合,使用化学-酶法合成天然产物具有高化学选择性、高立体选择性、高产率、低毒性等优势,在合成路径短的工艺中具有一定的优势,因此将化学-酶法引入合成工业具有广阔前景。胞内生产即搭建细胞工厂,通过对底盘细胞的改造、胞内酶和代谢通路的改造和调控等,使微生物直接代谢终产物。微生物细胞工厂(microbial cell factories, MCFs)已被广泛用于生产丰富多样的化学品、食品、药品和能源,是生物合成的核心环节。与体外酶催化生产方式不同的是,细胞工厂的最佳应用场景是大宗品/超大宗品和天然产物的生产上。细胞工厂的构造是胞内生产的关键点,围绕底盘细胞的选择与改造、基因合成、基因组编辑、合成途径设计等技术路线开展。其中,主要的底盘细胞包括大肠杆菌、枯草芽孢杆菌、谷氨酸棒杆菌、酿酒酵母、丝状真菌以及非模式细菌、非传统酵母等,构建细胞工厂需在底盘细胞的基础上应用调控、进化、高通量筛选等。在细胞工厂的构建中,涉及到的关键底层技术包括1)基因组编辑技术、2)多基因同时调控技术、3)基因动态调控技术、4)高通量筛选技术、5)代谢调控机制。目前市场上超过40%的小分子药物来源于天然产物及其类似物,虽然天然产物在人类已知化合物库中的占比较小,发展成为药物的比例却很高,尤其是在抗感染和抗肿瘤药物方面达到了50%,挖掘自然界中天然产物的价值,并以人工高效的方式制备天然产物,是学界和产业关注的两大研究热点。20世纪以来,有机化学家们通过有机反应实现天然产物在实验室内的全合成,但化学合成法的局限性在于难以适配于结构高度复杂的分子,部分反应化学试剂昂贵且反应条件极其苛刻,整体合成效率较低。因此,通过构建微生物细胞工厂生物合成天然产物的路线,成为业界关注点。利用生物发酵法合成天然产物及其中间体在工业生产中已有许多案例,包括萜类化合物、生物碱等。重组微生物发酵生产莽草酸,该工艺替代复杂化学工艺与提取法,成为了当前莽草酸生产的首选路线;青蒿素是我国发现的第一个被国际公认的抗疟首选天然药物,其结构为含过氧桥基团结构的倍半萜内酯类化合物,目前通过细胞工厂方法生产青蒿素已初步达到工业化生产水平;通过将设计改造的紫杉二烯合成酶导入大肠杆菌中,通过对模块进行调控获得生产紫杉醇前体化合物,产量比旧路线提高了1万倍以上。国内清华大学李春教授长期从事代谢工程与合成生物学、生物催化与酶工程的研究,聚焦甘草萜烯类和黄酮类天然产物的酶转化与微生物合成,工业菌种智能抗逆分子设计与工程应用。已完成植物油脂酶法脱胶、甘草次酸的生物制造、多重耐热酵母发酵生产乙醇等技术的中试试验,研制的植物解盐促生菌剂实现了产业化应用。目前,利用合成生物学手段实现实际社会生产中的天然产物合成仍然存在着诸多挑战。例如原核表达系统、细胞内无高级细胞器、缺乏转录后修饰,而酵母作为真核表达系统必须人为地将内含子从蛋白质编码序列中删除。越来越多的生物技术,如构建基因库、蛋白质工程、高通量筛选以及 CRISPR/Cas9 基因编辑技术等的发明与应用可解决上述难题。这些不断完善的新生物合成工具正随着具有重要药用价值的生物次生代谢物的生产成本与资源协调等相关问题的解决,逐步创造着更加可观的未来。为共同探讨生物学应用科学技术的流程与难点,在本次生物智造·绿色科技行业论坛应用科学分论坛环节,议题将紧扣四大应用科学技术,邀请到的行业领袖包括华南理工大学黄华研究员、华东理工大学郑高伟教授、中科院天津工业生物技术研究所袁波研究员、清华大学李春教授(按议题顺序排名,不分先后)。届时各位行业领袖将带来关于合成生物应用科学的深度解读,从现实应用难点出发,探索技术未来发展可能。深圳瑞德林生物技术有限公司,6年前诞生于深圳南山高新孵化器,如今已成为行业领跑者,是国内推动合成生物技术产业化的先行者之一。瑞德林汇聚多学科、全产业链的技术资源和创新要素,建设涵盖生物计算与人工智能、绿色化学、基因工程、酶工程、菌株工程、发酵工程、纯化工程、质量研究等十大技术领域的“绿色生物智造平台”,建立以“生命分子”高效生产和绿色工艺为导向,以酶为基础的核心技术体系。在该体系的支撑下,公司可快速实现产品的迭代与延伸,不仅能合成各种短肽、寡糖和核酸类功效原料,还能对其进行多种修饰、改造以增强其生物活性,在分子层面实现功效调控。公司总部位于深圳,在南山高新区建有近6,000 m2的研发实验室和1000 m2的中试GMP车间,并在英国成立子公司从事人工智能和类脑科学研究。截止目前,公司研发团队规模近300人,已申请技术发明专利近百项,专利内容覆盖核心技术及重点产品,以知识产权 “软实力”,实现技术研发 “硬支撑”。公司已先后获得国家专精特新“小巨人”、国家高新技术企业、深圳市专精特新中小企业、深圳市潜在独角兽企业、深圳市博士后创新实践基地、深圳医疗健康创新30强、珠海市创新创业团队、甘肃省专精特新中小企业等国家、地方等各类称号十余项,2022年入选深圳高成长企业TOP100,2023年入选哈佛商业评论高能创新团队。